PRIMERA LEY: CONSERVACIÓN DE ENERGÍA
El primer principio de la termodinámica es una ley de conservación de la energía y, a su vez, una definición precisa del concepto de calor. Afirma que, como la energía no se crea ni se destruye, la cantidad de energía que se transfiere a un sistema en forma de calor (Q) más la cantidad de energía transferida al sistema en forma de trabajo (W) debe ser igual al aumento de energía interna (U) del sistema. Matemáticamente, el primer principio de la termodinámica se puede enunciar de la manera siguiente:
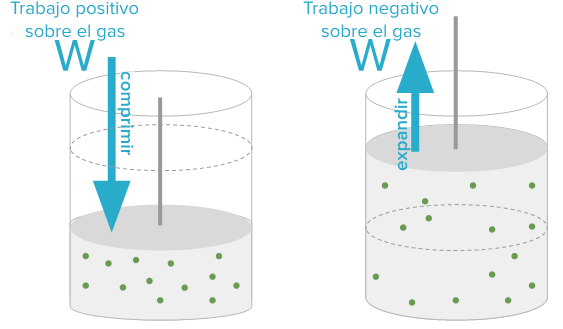 |
| Principio de la conservación de energía. |
Por ejemplo, cuando se calienta agua en un recipiente cerrado al hacer girar unas ruedas de paletas, el aumento de nivel energético del agua es proporcional al trabajo realizado para mover las ruedas de paletas. Cualquier máquina necesita cierta cantidad de energía para producir trabajo.

Comentarios
Publicar un comentario